La transició adiabàtica entre dos estats en gasos no és un dels isoprocessos, però té un paper important no només en diversos processos tecnològics, sinó també en la naturalesa. En aquest article, considerarem quin és aquest procés i també donarem les equacions adiabàtiques d'un gas ideal.
Gasolina ideal en breu
Un gas ideal és aquell en què no hi ha interaccions entre les seves partícules i les seves mides són iguals a zero. A la natura, és clar, no hi ha gasos cent per cent ideals, ja que tots estan compostos per molècules i àtoms de mida, que sempre interactuen entre si, almenys amb l'ajuda de les forces de van der Waals. No obstant això, el model descrit sovint es realitza amb prou precisió per resoldre problemes pràctics per a molts gasos reals.
L'equació principal d'un gas ideal és la llei de Clapeyron-Mendeleiev. S'escriu de la següent forma:
PV=nRT.
Aquesta equació estableix una proporcionalitat directa entre el productela pressió P sobre el volum V i la quantitat de substància n sobre la temperatura absoluta T. El valor de R és la constant del gas, que juga el paper de factor de proporcionalitat.
Què és un procés adiabàtic?
Un procés adiabàtic és una transició entre els estats d'un sistema de gas en què no hi ha intercanvi d'energia amb el medi. En aquest cas, les tres característiques termodinàmiques del sistema (P, V, T) canvien i la quantitat de substància n es manté constant.
Distingeix entre l'expansió adiabàtica i la contracció. Tots dos processos es produeixen només a causa de l'energia interna del sistema. Així, com a conseqüència de l'expansió, la pressió i sobretot la temperatura del sistema cauen dràsticament. Per contra, la compressió adiabàtica provoca un s alt positiu de temperatura i pressió.
Per evitar l'intercanvi de calor entre l'entorn i el sistema, aquest últim ha de tenir parets aïllades tèrmicament. A més, escurçant el temps del procés es redueix significativament el flux de calor cap i des del sistema.
Equacions de Poisson per a un procés adiabàtic

La primera llei de la termodinàmica s'escriu de la següent manera:
Q=ΔU + A.
En altres paraules, la calor Q comunicada al sistema s'utilitza per realitzar el treball A del sistema i augmentar la seva energia interna ΔU. Per escriure l'equació adiabàtica cal posar Q=0, que correspon a la definició del procés objecte d'estudi. Obtenim:
ΔU=-A.
Amb isocòricprocés en un gas ideal, tota la calor es destina a augmentar l'energia interna. Aquest fet ens permet escriure la igu altat:
ΔU=CVΔT.
On CV és la capacitat calorífica isocòrica. El treball A, al seu torn, es calcula de la següent manera:
A=PdV.
On dV és un petit canvi de volum.
A més de l'equació de Clapeyron-Mendeleev, l'equació següent és vàlida per a un gas ideal:
CP- CV=R.
On CP és la capacitat calorífica isobàrica, que sempre és superior a la isocòrica, ja que té en compte les pèrdues de gas per dilatació.
Analitzant les equacions escrites anteriorment i integrant la temperatura i el volum, arribem a la següent equació adiabàtica:
TVγ-1=const.
Aquí γ és l'índex adiabàtic. És igual a la relació entre la capacitat calorífica isobàrica i la isocòrica. Aquesta igu altat s'anomena equació de Poisson per a un procés adiabàtic. Aplicant la llei de Clapeyron-Mendeleev, podeu escriure dues expressions semblants més, només mitjançant els paràmetres P-T i P-V:
TPγ/(γ-1)=const;
PVγ=const.
El gràfic adiabàtic es pot donar en diferents eixos. A sota es mostra en eixos P-V.
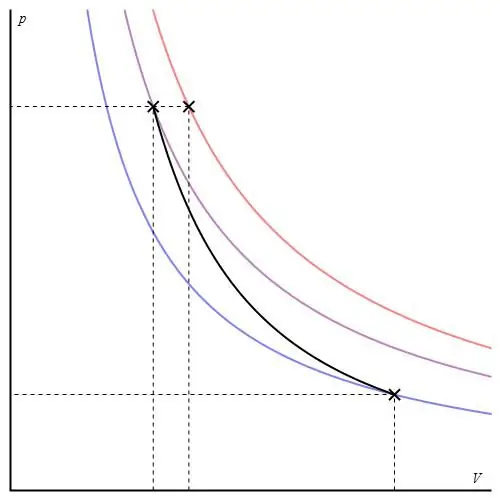
Les línies de colors del gràfic corresponen a isotermes, la corba negra és un adiabat. Com es pot veure, l'adiabat es comporta més fort que qualsevol de les isotermes. Aquest fet és fàcil d'explicar: per a la isoterma, la pressió torna a canviarproporcional al volum, però per a l'isòbat, la pressió canvia més ràpidament, ja que l'exponent és γ>1 per a qualsevol sistema de gas.
Problema d'exemple
A la natura, a les zones muntanyoses, quan la massa d'aire puja pel vessant, la seva pressió baixa, augmenta de volum i es refreda. Aquest procés adiabàtic redueix el punt de rosada i produeix precipitacions líquides i sòlides.

Es proposa resoldre el següent problema: en el procés d'elevació de la massa d'aire pel vessant de la muntanya, la pressió va baixar un 30% respecte a la pressió al peu. Quina era la seva temperatura igual si al peu feia 25 oC?
Per resoldre el problema, utilitzeu l'equació adiabàtica següent:
TPγ/(γ-1)=const.
És millor escriure-ho en aquesta forma:
T2/T1=(P2/P 1)(γ-1)/γ.
Si P1 es pren com a 1 atmosfera, aleshores P2 serà igual a 0,7 atmosferes. Per a l'aire, l'índex adiabàtic és 1,4, ja que es pot considerar un gas ideal diatòmic. El valor de temperatura de T1 és 298,15 K. Substituint tots aquests nombres a l'expressió anterior, obtenim T2=269,26 K, que correspon a - 3, 9 oC.






