En termodinàmica, quan s'estudien les transicions de l'estat inicial al final d'un sistema, és important conèixer l'efecte tèrmic del procés. El concepte de capacitat calorífica està estretament relacionat amb aquest efecte. En aquest article, considerarem la qüestió de què s'entén per la capacitat calorífica isocòrica d'un gas.
Gasolina ideal
Un gas ideal és un gas les partícules del qual es consideren punts materials, és a dir, no tenen dimensions, sinó massa, i en el qual tota l'energia interna consisteix únicament en l'energia cinètica del moviment de les molècules. i àtoms.
Qualsevol gas real idealment mai satisfarà el model descrit, ja que les seves partícules encara tenen algunes dimensions lineals i interactuen entre elles mitjançant enllaços febles de van der Waals o enllaços químics d'un altre tipus. Tanmateix, a baixes pressions i altes temperatures, les distàncies entre molècules són grans i la seva energia cinètica supera l'energia potencial en desenes de vegades. Tot això fa possible aplicar amb un alt grau de precisió el model ideal per a gasos reals.
Energia interna del gas
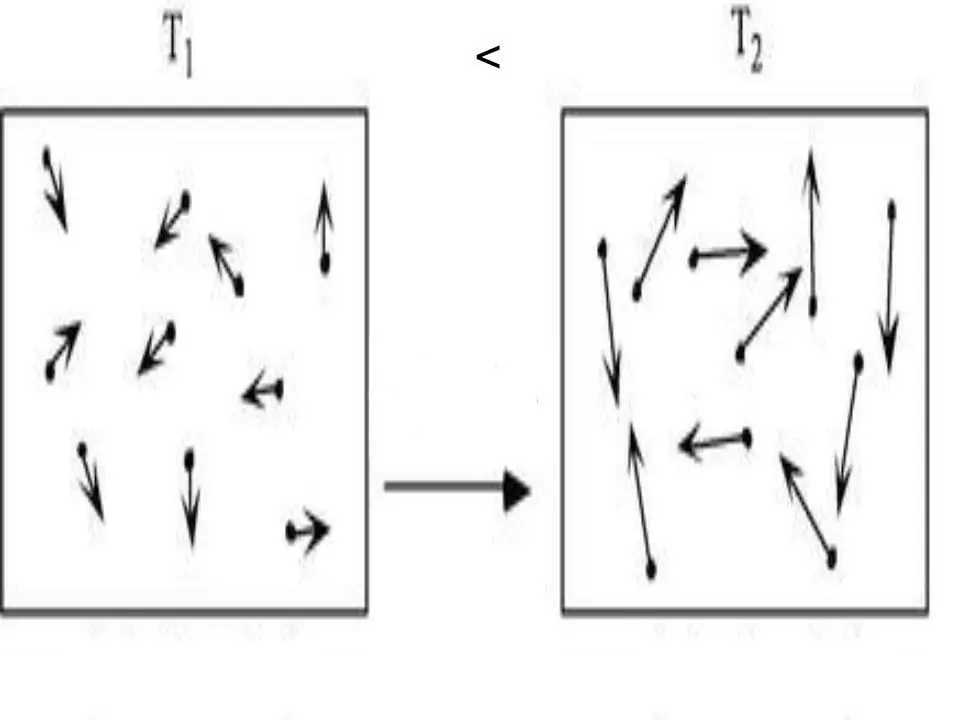
L'energia interna de qualsevol sistema és una característica física, que és igual a la suma de l'energia potencial i cinètica. Com que l'energia potencial es pot descuidar en els gasos ideals, podem escriure'ls la igu altat:
U=Ek.
On Ek és l'energia del sistema cinètic. Utilitzant la teoria cinètica molecular i aplicant l'equació d'estat universal de Clapeyron-Mendeleev, no és difícil obtenir una expressió per a U. S'escriu a continuació:
U=z/2nRT.
Aquí T, R i n són la temperatura absoluta, la constant del gas i la quantitat de substància, respectivament. El valor z és un nombre enter que indica el nombre de graus de llibertat que té una molècula de gas.
Capacitat de calor isobàrica i isocòrica
En física, la capacitat calorífica és la quantitat de calor que s'ha de proporcionar al sistema en estudi per escalfar-lo en un kelvin. La definició inversa també és certa, és a dir, la capacitat calorífica és la quantitat de calor que allibera el sistema quan es refreda en un kelvin.
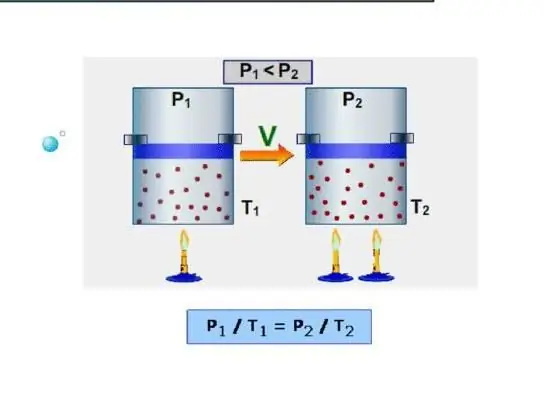
La manera més senzilla d'un sistema és determinar la capacitat calorífica isocòrica. S'entén com la capacitat calorífica a volum constant. Com que el sistema no treballa en aquestes condicions, tota l'energia es gasta per augmentar les reserves d'energia internes. Denotem la capacitat calorífica isocòrica amb el símbol CV, llavors podem escriure:
dU=CVdT.
És a dir, el canvi d'energia internasistema és directament proporcional al canvi de temperatura. Si comparem aquesta expressió amb la igu altat escrita en el paràgraf anterior, arribem a la fórmula de CV en un gas ideal:
СV=z/2nR.
Aquest valor és incòmode d'utilitzar a la pràctica, ja que depèn de la quantitat de substància del sistema. Per tant, es va introduir el concepte de capacitat calorífica isocòrica específica, és a dir, un valor que es calcula per 1 mol de gas o per 1 kg. Denotem el primer valor amb el símbol CV, el segon amb el símbol CV m. Per a ells, podeu escriure les següents fórmules:
CV=z/2R;
CVm=z/2R/M.
Aquí M és la massa molar.
Isobàric és la capacitat calorífica mantenint una pressió constant al sistema. Un exemple d'aquest procés és l'expansió del gas en un cilindre sota un pistó quan s'escalfa. A diferència del procés isocòric, durant el procés isobàric, la calor subministrada al sistema es gasta per augmentar l'energia interna i per realitzar un treball mecànic, és a dir:
H=dU + PdV.
L'entalpia d'un procés isobàric és el producte de la capacitat calorífica isobàrica i el canvi de temperatura en el sistema, és a dir:
H=CPdT.
Si considerem l'expansió a una pressió constant d'1 mol de gas, aleshores la primera llei de la termodinàmica s'escriurà com:
CPdT=CV dT + RdT.
L'últim terme s'obté de l'equacióClapeyron-Mendeleiev. D'aquesta igu altat es desprèn la relació entre les capacitats calorífiques isòbàriques i isocòriques:
CP=CV + R.
Per a un gas ideal, la capacitat calorífica molar específica a pressió constant és sempre més gran que la característica isocòrica corresponent per R=8, 314 J/(molK).
Graus de llibertat de molècules i capacitat calorífica
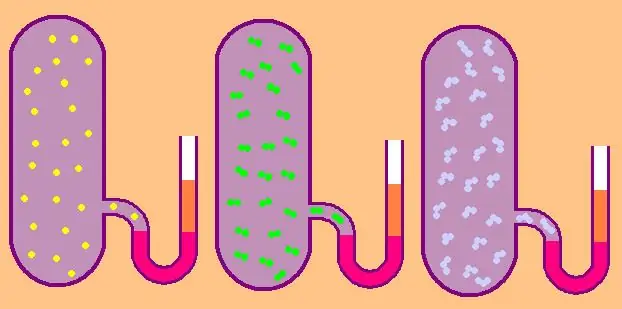
Escrivim de nou la fórmula per a la capacitat calorífica isocòrica molar específica:
CV=z/2R.
En el cas d'un gas monoatòmic, el valor z=3, ja que els àtoms de l'espai només es poden moure en tres direccions independents.
Si estem parlant d'un gas format per molècules diatòmiques, per exemple, oxigen O2 o hidrogen H2, aleshores, a més del moviment de translació, aquestes molècules encara poden girar al voltant de dos eixos mútuament perpendiculars, és a dir, z serà igual a 5.
Per a molècules més complexes, utilitzeu z=6. per determinar CV






