El coneixement de les definicions de la física és un factor clau per resoldre amb èxit diversos problemes físics. A l'article, considerarem què s'entén per processos isobàrics, isocòrics, isotèrmics i adiabàtics per a un sistema de gasos ideals.
El gas ideal i la seva equació
Abans de procedir a la descripció dels processos isobàrics, isocòrics i isotèrmics, considerem què és un gas ideal. Sota aquesta definició en física consideren un sistema format per un gran nombre de partícules adimensionals i que no interactuen que es mouen a gran velocitat en totes direccions. De fet, estem parlant d'un estat agregat gasós de la matèria, en el qual les distàncies entre àtoms i molècules superen amb escreix les seves mides i en el qual es descuida l'energia potencial d'interacció de les partícules per la seva petitesa, en comparació amb l'energia cinètica.
L'estat d'un gas ideal és la totalitat dels seus paràmetres termodinàmics. Els principals són la temperatura, el volum i la pressió. Denotem-los amb les lletres T, V i P, respectivament. Als anys 30 del segle XIXClapeyron (un científic francès) va escriure per primera vegada una equació que combina els paràmetres termodinàmics indicats dins d'una única igu altat. Sembla:
PV=nRT,
on n i R són la quantitat de substàncies i la constant de gas, respectivament.
Què són els isoprocessos dels gasos?
Com molts han notat, els processos isobàrics, isocòrics i isotèrmics utilitzen el mateix prefix "iso" en els seus noms. Significa la igu altat d'un paràmetre termodinàmic durant el pas de tot el procés, mentre que la resta de paràmetres canvien. Per exemple, un procés isotèrmic indica que, com a resultat, la temperatura absoluta del sistema es manté constant, mentre que un procés isocòric indica un volum constant.
Els isoprocessos són convenients d'estudiar, ja que fixar un dels paràmetres termodinàmics comporta una simplificació de l'equació general de l'estat del gas. És important tenir en compte que les lleis dels gasos per a tots aquests isoprocessos es van descobrir experimentalment. La seva anàlisi va permetre a Clapeyron obtenir l'equació universal reduïda.
Processos isobàrics, isocòrics i isotèrmics
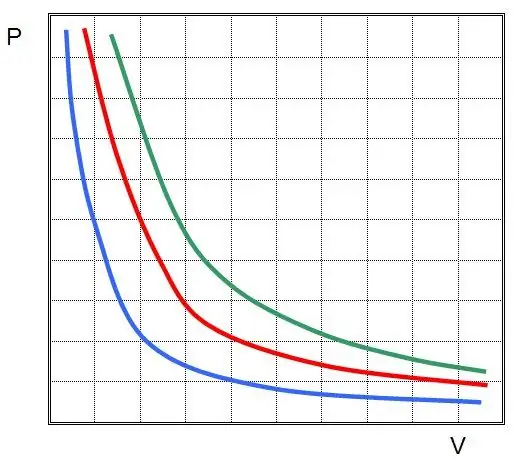
La primera llei es va descobrir per a un procés isotèrmic en un gas ideal. Ara s'anomena llei de Boyle-Mariotte. Com que T no canvia, l'equació d'estat implica la igu altat:
PV=const.
En altres paraules, qualsevol canvi de pressió en el sistema comporta un canvi inversament proporcional en el seu volum, si la temperatura del gas es manté constant. La gràfica de la funció P(V) éshipèrbole.
Procés isobàric: és un canvi en l'estat del sistema, en què la pressió es manté constant. Un cop fixat el valor de P a l'equació de Clapeyron, obtenim la llei següent:
V/T=const.
Aquesta igu altat porta el nom del físic francès Jacques Charles, que la va rebre a finals del segle XVIII. La isòbara (representació gràfica de la funció V(T)) sembla una línia recta. Com més pressió hi hagi al sistema, més ràpid augmenta aquesta línia.
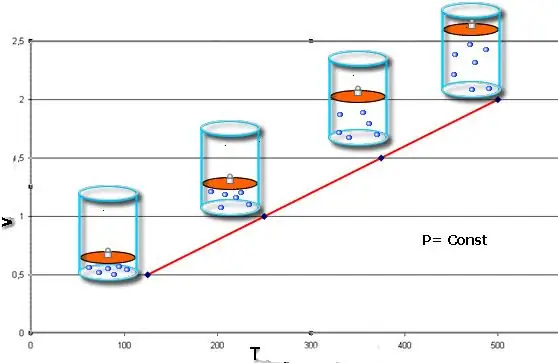
El procés isobàric és fàcil d'implementar si el gas s'escalfa sota el pistó. Les molècules d'aquest últim augmenten la seva velocitat (energia cinètica), creen una pressió més alta sobre el pistó, la qual cosa comporta l'expansió del gas i el manteniment d'un valor constant de P.
Finalment, el tercer isoprocés és isocòric. Funciona amb un volum constant. De l'equació d'estat obtenim la igu altat corresponent:
P/T=const.
Es coneix entre els físics com la llei de Gay-Lussac. La proporcionalitat directa entre la pressió i la temperatura absoluta indica que la gràfica del procés isòcric, com la gràfica de l'isobàric, és una recta amb un pendent positiu.
És important entendre que tots els isoprocessos es produeixen en sistemes tancats, és a dir, el valor de n es conserva durant el seu curs.
Procés adiabàtic
Aquest procés no pertany a la categoria "iso", ja que els tres paràmetres termodinàmics canvien durant el seu pas. adiabàticanomenada transició entre dos estats del sistema, en què no intercanvia calor amb l'ambient. Així, l'expansió del sistema es realitza a causa de les seves reserves energètiques internes, la qual cosa comporta una caiguda important de pressió i temperatura absoluta en el mateix.
El procés adiabàtic d'un gas ideal es descriu mitjançant les equacions de Poisson. Un d'ells es mostra a continuació:
PVγ=const,
on γ és la relació de les capacitats calorífices a pressió constant i a volum constant.
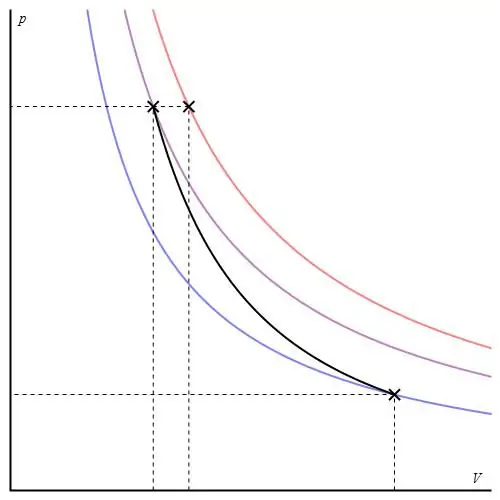
El gràfic adiabàtic difereix del gràfic del procés isocòric i del gràfic isobàric, però és similar a una hipèrbola (isoterma). L'adiabat dels eixos P-V es comporta de manera més aguda que la isoterma.






